manipulasi gugus fungsi III
Oxidation and reduction protocols
Sebagian besar reaksi redoks yang telah Anda lihat sebelumnya dalam kimia umum mungkin melibatkan aliran elektron dari satu logam ke logam lain, seperti reaksi antara ion tembaga dalam larutan dan seng metalik:
Cu + 2 (aq) + Zn (s) → Cu (s) + Zn + 2 (aq)
Dalam kimia organik, reaksi redoks terlihat sedikit berbeda. Elektron dalam reaksi redoks organik sering ditransfer dalam bentuk ion hidrida - proton dan dua elektron. Karena mereka terjadi bersamaan dengan transfer proton, ini biasanya disebut sebagai reaksi hidrogenasi dan dehidrogenasi: hidrida ditambah proton ditambahkan ke molekul hidrogen (H2). Hati-hati - jangan bingung istilah hidrogenasi dan dehidrogenasi dengan hidrasi dan dehidrasi - yang terakhir mengacu pada perolehan dan hilangnya molekul air (dan bukan reaksi redoks), sedangkan yang pertama mengacu pada perolehan dan hilangnya molekul hidrogen. Ketika sebuah atom karbon dalam senyawa organik kehilangan ikatan pada hidrogen dan memperoleh ikatan baru pada heteroatom (atau karbon lain), kita mengatakan bahwa senyawa tersebut telah terdehidrogenasi, atau teroksidasi. Contoh biokimia yang sangat umum adalah oksidasi alkohol menjadi keton atau aldehida :
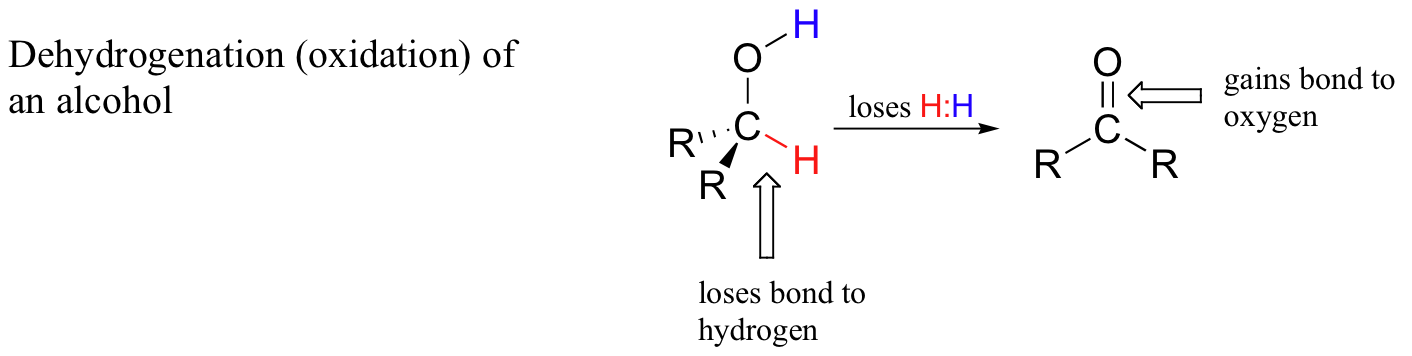 Ketika sebuah atom karbon kehilangan ikatan ke hidrogen dan memperoleh ikatan ke heteroatom (atau atom karbon lain), ia dianggap sebagai proses oksidatif karena hidrogen, dari semua elemen, adalah yang paling elektronegatif. Dengan demikian, dalam proses dehidrogenasi atom karbon mengalami kehilangan densitas elektron secara keseluruhan - dan kehilangan elektron adalah oksidasi.
Ketika sebuah atom karbon kehilangan ikatan ke hidrogen dan memperoleh ikatan ke heteroatom (atau atom karbon lain), ia dianggap sebagai proses oksidatif karena hidrogen, dari semua elemen, adalah yang paling elektronegatif. Dengan demikian, dalam proses dehidrogenasi atom karbon mengalami kehilangan densitas elektron secara keseluruhan - dan kehilangan elektron adalah oksidasi.
Sebaliknya, ketika atom karbon dalam senyawa organik mendapatkan ikatan hidrogen dan kehilangan ikatan ke heteroatom (atau atom karbon lain), kita mengatakan bahwa senyawa tersebut telah terhidrogenasi, atau berkurang. Hidrogenasi keton ke alkohol, misalnya, secara keseluruhan kebalikan dari dehidrogenasi alkohol.
Hidrogenasi menghasilkan kerapatan elektron yang lebih tinggi pada atom karbon, dan dengan demikian kami menganggap proses sebagai salah satu pengurangan molekul organik.
Perhatikan bahwa baik hidrogenasi maupun dehidrogenasi tidak melibatkan perolehan atau kehilangan atom oksigen. Reaksi yang melibatkan perolehan atau kehilangan satu atau lebih atom oksigen biasanya disebut sebagai reaksi 'oksigenase' dan 'reduktase',
Oksidasi senyawa organik merupakan keadaan terjadinya pembentukan ikatan antara karbon dan atom yang lebih elektronegatif (biasanya O, N, atau halogen) atau dengan pemutusan ikatan antara karbon dan atom kurang elektronegatif (biasanya H) sehingga dapat menghilangkan kerapatan elektron pada karbon yang disebabkan oleh. Sebaliknya, reduksi organik menghasilkan penguatan kerapatan elektron pada karbon yang disebabkan oleh pembentukan ikatan antara karbon dan atom yang kurang elektronegatif atau dengan pemutusan ikatan antara karbon dan atom yang lebih elektronegatif.
Oksidasi mengurangi densitas elektron pada karbon dengan :
- Membentuk salah satu dari : C-O; C-N; C-X
- Memutuskan ikatan : C-H
Reduksi meningkatkan kerapatan elektron pada karbon dengan :
- Membentuk : C-H
- Memutuskan salah satu dari : C-O; C-N; C-X
Berdasarkan definisi ini, maka reaksi klorinasi metana untuk menghasilkan klorometana adalah oksidasi karena ikatan C-H rusak dan terbentuk ikatan C-Cl. Sedangkan, pada konversi alkil klorida menjadi alkana melalui pereaksi Grignard diikuti oleh protonasi adalah reduksi karena ikatan C-Cl rusak dan terbentuk ikatan baru C-H.
Berikut skemanya :
Namun pada contoh lain, reaksi alkena dengan Br2 menghasilkan 1,2-dibromide adalah reaksi oksidasi karena dua ikatan C-Br terbentuk, tetapi reaksi alkena dengan HBr menghasilkan alkil bromida bukanlah oksidasi maupun reduksi karena ikatan C-H dan C-Br terbentuk.
Berikut daftar senyawa berdasarkan peningkatan tingkat oksidasinya :
Alkana berada pada tingkat oksidasi terendah karena mereka memiliki jumlah maksimum ikatan C-H per karbon, dan CO2 berada pada tingkat tertinggi karena memiliki kemungkinan jumlah maksimum ikatan C-O per karbon. Setiap reaksi yang mengubah senyawa dari tingkat yang lebih rendah ke tingkat yang lebih tinggi adalah oksidasi, setiap reaksi yang mengubah suatu senyawa dari tingkat yang lebih tinggi ke tingkat yang lebih rendah adalah reduksi, dan setiap reaksi yang tidak mengubah tingkat bukanlah oksidasi maupun reduksi.
Aldehid dan keton sama-sama mempunyai gugus karbonil (C=O). Dengan demikian, sifat fisika dan kimia keduanya hampir sama. Aldehid dan keton dapat dikenai reaksi reduksi maupun oksidasi, dan menghasilkan senyawa organik golongan lain.
Reaksi oksidasi terhadap aldehid menggunakan reagen oksidator yang bervariasi akan menghasilkan asam karboksilat. Oksidator yang paling umum digunakan untuk aldehid adalah kalium dikromat. Aldehid juga dapat teroksidasi menjadi asam karboksilat oleh oksigen bebas di udara.
Senyawa golongan keton sukar dioksidasi menggunakan oksidator apapun, termasuk kalium dikromat dan oksigen molekuler. Aldehida mudah dioksidasi sedangkan keton tidak bisa dioksidasi
Aldehida direduksi menghasilkan alkohol primer, sedangkan keton menghasilkan alkohol sekunder.
Reduksi ikatan rangkap C=O lebih sulit direduksi daripada ikatan rangkap C=C. Dengan demikian, jika suatu senyawa mengandung gugus C=O dan C=C dikenai reaksi reduksi, maka C=C akan tereduksi terlebih dahulu.
Reaksi transfer asil (misalnya konversi dari asil fosfat ke amida) tidak dianggap sebagai reaksi redoks - keadaan oksidasi dari molekul organik tidak berubah ketika substrat diubah menjadi produk, karena ikatan ke satu heteroatom (Oksigen) telah diperdagangkan untuk sebuah ikatan dengan heteroatom (nitrogen) lain. Penting untuk dapat mengenali kapan molekul organik dioksidasi atau direduksi, karena informasi ini memberitahu Anda untuk mencari partisipasi dari agen redoks yang sesuai yang sedang dikurangi atau teroksidasi - ingat, oksidasi dan reduksi selalu terjadi bersamaan
1. Senyawa golongan keton sukar dioksidasi menggunakan oksidator apapun, termasuk kalium dikromat dan oksigen molekuler mengapa bisa demikian dan apa penyebabnya..?
2. Sebagian besar reaksi redoks yang telah kita lihat sebelumnya dalam kimia umum mungkin melibatkan aliran elektron dari satu logam ke logam lain sedangkan Dalam kimia organik, reaksi redoks terlihat sedikit berbeda. mengapa hal tersebut berbeda padahal mengalami hal yang serupa ?
3. bagaimana cara untuk dapat mengenali kapan molekul organik itu dioksidasi atau direduksi ?



Saya akan menjawab nomor 2.
BalasHapusKarena dalam kimia organik, elektron dalam reaksi redoks organik sering ditransfer dalam bentuk ion hidrida - proton dan dua elektron. Karena mereka terjadi bersamaan dengan transfer proton, ini biasanya disebut sebagai reaksi hidrogenasi dan dehidrogenasi: hidrida ditambah proton ditambahkan ke molekul hidrogen (H2).
Saya akan menjawab nomor 2.
BalasHapusKarena dalam kimia organik, elektron dalam reaksi redoks organik sering ditransfer dalam bentuk ion hidrida - proton dan dua elektron. Karena mereka terjadi bersamaan dengan transfer proton, ini biasanya disebut sebagai reaksi hidrogenasi dan dehidrogenasi: hidrida ditambah proton ditambahkan ke molekul hidrogen (H2).
Permasalahan 2 Karena mereka terjadi bersamaan dengan transfer proton, ini biasanya disebut sebagai reaksi hidrogenasi dan dehidrogenasi: hidrida ditambah proton ditambahkan ke molekul hidrogen (H2).
BalasHapusPermasalahan 2 Karena mereka terjadi bersamaan dengan transfer proton, ini biasanya disebut sebagai reaksi hidrogenasi dan dehidrogenasi: hidrida ditambah proton ditambahkan ke molekul hidrogen (H2).
BalasHapusSaya akan menjawab nomor 2.
BalasHapusKarena dalam kimia organik, elektron dalam reaksi redoks organik sering ditransfer dalam bentuk ion hidrida - proton dan dua elektron. Karena mereka terjadi bersamaan dengan transfer proton, ini biasanya disebut sebagai reaksi hidrogenasi dan dehidrogenasi: hidrida ditambah proton ditambahkan ke molekul hidrogen (H2).
Dalam kimia organik, reaksi redoks terlihat sedikit berbeda. Elektron dalam reaksi redoks organik sering ditransfer dalam bentuk ion hidrida - proton dan dua elektron. Karena mereka terjadi bersamaan dengan transfer proton, ini biasanya disebut sebagai reaksi hidrogenasi dan dehidrogenasi: hidrida ditambah proton ditambahkan ke molekul hidrogen (H2). Hati-hati - jangan bingung istilah hidrogenasi dan dehidrogenasi dengan hidrasi dan dehidrasi - yang terakhir mengacu pada perolehan dan hilangnya molekul air (dan bukan reaksi redoks), sedangkan yang pertama mengacu pada perolehan dan hilangnya molekul hidrogen. Ketika sebuah atom karbon dalam senyawa organik kehilangan ikatan pada hidrogen dan memperoleh ikatan baru pada heteroatom (atau karbon lain), kita mengatakan bahwa senyawa tersebut telah terdehidrogenasi, atau teroksidasi
BalasHapusimage006.pngKetika sebuah atom karbon kehilangan ikatan ke hidrogen dan memperoleh ikatan ke heteroatom (atau atom karbon lain), ia dianggap sebagai proses oksidatif karena hidrogen, dari semua elemen, adalah yang paling elektronegatif. Dengan demikian, dalam proses dehidrogenasi atom karbon mengalami kehilangan densitas elektron secara keseluruhan - dan kehilangan elektron adalah oksidasi.
BalasHapusKetika sebuah atom karbon kehilangan ikatan ke hidrogen dan memperoleh ikatan ke heteroatom (atau atom karbon lain), ia dianggap sebagai proses oksidatif karena hidrogen, dari semua elemen, adalah yang paling elektronegatif. Dengan demikian, dalam proses dehidrogenasi atom karbon mengalami kehilangan densitas elektron secara keseluruhan - dan kehilangan elektron adalah oksidasi.
BalasHapusPermasalahan 2 Karena mereka terjadi bersamaan dengan transfer proton, ini biasanya disebut sebagai reaksi hidrogenasi dan dehidrogenasi: hidrida ditambah proton ditambahkan ke molekul hidrogen (H2).
BalasHapusPermasalahan 2 Karena mereka terjadi bersamaan dengan transfer proton, ini biasanya disebut sebagai reaksi hidrogenasi dan dehidrogenasi: hidrida ditambah proton ditambahkan ke molekul hidrogen (H2).
BalasHapusjawaban permasalahan nomor 1
BalasHapussenyawa golongan keton sukar dioksidasi menggunakan oksidator apapun, termasuk kalium dikromat dan oksigen molekuler. Aldehida mudah dioksidasi sedangkan keton tidak bisa dioksidasi
Aldehida direduksi menghasilkan alkohol primer, sedangkan keton menghasilkan alkohol sekunder.
Reduksi ikatan rangkap C=O lebih sulit direduksi daripada ikatan rangkap C=C. Dengan demikian, jika suatu senyawa mengandung gugus C=O dan C=C dikenai reaksi reduksi, maka C=C akan tereduksi terlebih dahulu.
Reaksi transfer asil (misalnya konversi dari asil fosfat ke amida) tidak dianggap sebagai reaksi redoks - keadaan oksidasi dari molekul organik tidak berubah ketika substrat diubah menjadi produk, karena ikatan ke satu heteroatom (Oksigen) telah diperdagangkan untuk sebuah ikatan dengan heteroatom (nitrogen) lain. Penting untuk dapat mengenali kapan molekul organik dioksidasi atau direduksi, karena informasi ini memberitahu Anda untuk mencari partisipasi dari agen redoks yang sesuai yang sedang dikurangi atau teroksidasi - ingat, oksidasi dan reduksi selalu terjadi bersamaan
Saya akan menjawab nomor 2.
BalasHapusKarena dalam kimia organik, elektron dalam reaksi redoks organik sering ditransfer dalam bentuk ion hidrida - proton dan dua elektron. Karena mereka terjadi bersamaan dengan transfer proton, ini biasanya disebut sebagai reaksi hidrogenasi dan dehidrogenasi: hidrida ditambah proton ditambahkan ke molekul hidrogen (H2).